COVID: Cofepris autoriza el uso de emergencia de esta pastilla de Pfizer
Transparencia | 14 de Enero de 2022 | por: Redacción
La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) autorizó hoy viernes el uso de emergencia del tratamiento Paxlovid, del laboratorio estadounidense, Pfizer.
Paxlovid, que combina nirmatrelvir y ritonavir en presentación de tabletas, será utilizado en pacientes adultos con COVID leve o moderado y con riesgo de complicaciones.
El medicamento requerirá de prescripción médica, considerando los factores de empleo y riesgo detallados en el oficio de autorización para evitar mal uso de este medicamento, automedicación y/o su venta irregular.
Los dos componentes de Paxlovid trabajan en conjunto para reducir hasta 88% la tasa de hospitalización y mortalidad a causa de este virus. El primero, nirmatrelvir, inhibe una proteína del SARS-CoV-2, impidiendo que el virus se replique; mientras que el segundo, ritonavir, desacelera la descomposición del medicamento para ayudar a que este permanezca en el organismo más tiempo.
Esta autorización para uso de emergencia controlada se emite después del análisis técnico realizado por personal especializado de Cofepris, quienes examinaron la evidencia científica presentada por la farmacéutica Pfizer S.A de C.V. Previamente, expertas y expertos del Comité Nacional de Ciencia Tecnología e Innovación en Salud Pública del Consejo Nacional de Ciencia y Tecnología (Conacyt), y el Comité de Moléculas Nuevas de Cofepris, emitieron opiniones favorables unánimes sobre Paxlovid.
La evidencia se basa en el ensayo clínico aleatorio, doble ciego y controlado con placebo EPIC-HR, el cual estudió el tratamiento en personas de 18 años en adelante en más de 20 países, incluyendo México.


 Respaldan excandidatos a Abraham Salazar para la presidencia de Texmelucan
Respaldan excandidatos a Abraham Salazar para la presidencia de Texmelucan
 ¡Se acabo la espera! Abraham Salazar es ratificado por el INE como candidato de Texmelucan
¡Se acabo la espera! Abraham Salazar es ratificado por el INE como candidato de Texmelucan
 IEE ratifica a Abraham Salazar como candidato a presidente municipal de Texmelucan
IEE ratifica a Abraham Salazar como candidato a presidente municipal de Texmelucan
 Catea la FGR cinco inmuebles en Tlahuapan por venta de huachicol
Catea la FGR cinco inmuebles en Tlahuapan por venta de huachicol
 Vecinos de Tlalancaleca se manifiestan por tiradero clandestino
Vecinos de Tlalancaleca se manifiestan por tiradero clandestino
 Popocatépetl 'le baja' a su actividad; registra 30 exhalaciones
Popocatépetl 'le baja' a su actividad; registra 30 exhalaciones
 Detienen a sujeto que agredió a la activista Olimpia Coral Melo en Puebla
Detienen a sujeto que agredió a la activista Olimpia Coral Melo en Puebla
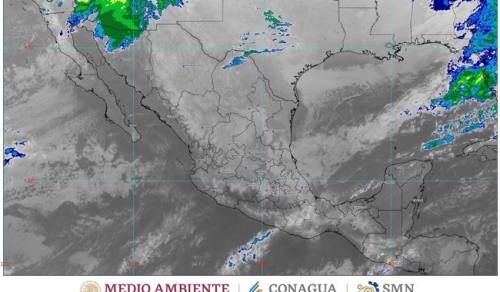 En próximas horas se prevén lluvias fuertes en Puebla, Chiapas, Oaxaca y Veracruz
En próximas horas se prevén lluvias fuertes en Puebla, Chiapas, Oaxaca y Veracruz
 Arranca el 2024 con 60 homicidios en México
Arranca el 2024 con 60 homicidios en México
 SSP recuperó un camión de carga robado en San Martín Texmelucan
SSP recuperó un camión de carga robado en San Martín Texmelucan
 Embolsado y al fondo de un pozo hallan cadáver de persona en Ahuatlán
Embolsado y al fondo de un pozo hallan cadáver de persona en Ahuatlán
 Hallan tres cadáveres con cinta gris en la cabeza al interior de una camioneta abandonada
Hallan tres cadáveres con cinta gris en la cabeza al interior de una camioneta abandonada